Akkumulatoren - Sekundärzellen
Im Gegensatz zur Primärzelle können bei einer Sekundärzelle durch Zufuhr elektrischer Energie die chemischen Zellreaktionen umgekehrt werden. Die elektrochemische Zelle wird zum vielfach regenerierbaren Ladungsspeicher. Aufladbare Akkus gibt es mit sauren oder alkalischen Elektrolyten. Neben dem altbekannten Blei-Akkumulator werden nachfolgend weitere Standardtypen beschrieben: Nickel-Eisen-Akku, Nickel-Cadmium-Akku, Nickel-Metallhydrid-Akku, Lithium-Ionen-Akku, Lithium-Polymer-Akku.
Bleiakkumulator
Ein aus der KFZ-Technik sehr bekanntes Sekundärelement ist der Bleiakku. Der außen bezeichnete Minuspol steht mit einer Bleiplatte und der Pluspol mit Bleidioxid in Verbindung, das in eine Gitterplatte eingepresst ist. Der Elektrolyt ist verdünnte Schwefelsäure. Bei auslaufsicheren Akkus bildet ist sie mit Kieselsäure ein Feuchtgel oder befindet sich aufgesaugt in Zwischenlagen aus Glasfaser-Vlies.
Arbeitet der Bleiakku als Energiequelle, so geht metallisches Blei oxidativ als positiv zweiwertige Bleiionen in Lösung. Die frei gewordenen Elektronen bleiben in der Elektrode, die mit negativem Potenzial zum Minuspol wird. Die Bleiionen reagieren mit dem Elektrolyten zu schwer löslichem Bleisulfat, wobei formal zwei freie Wasserstoffionen (Hydroniumionen) im Elektrolyten bleiben. Am Pluspol werden vierwertig positive Bleiionen des Bleidioxids zu positiv zweiwertigen Bleiionen reduziert. Sie reagieren mit dem Elektrolyten zu Bleisulfat und Wasser. Das formal verbleibende Sauerstoffion der Anodenreaktion reagiert mit den Wasserstoffionen der Kathodenreaktion zu einem weiteren Wassermolekül.
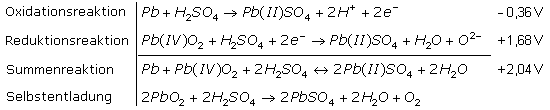
Bei der Entladung lagert sich schwer lösliches Bleisulfat auf den Elektroden ab und gleichzeitig wird der Elektrolyt durch das entstehende Wasser stark verdünnt. Die Leerlaufspannung der geladenen Zelle nimmt dadurch ab. Bezogen auf die Normalwasserstoff-Elektrode beträgt die Zellenspannung des geladenen Akkus 2,04 V. Auch ohne Energieentnahme findet eine langsame Selbstentladung statt, da das Bleidioxid in Schwefelsäure nicht dauerhaft beständig ist. Eine Tiefentladung verkürzt die Lebensdauer der Bleiakkumulatoren.
Für die unterschiedlichen Bauformen werden für geladene Blei-Schwefelsäure-Akkus unterschiedliche Leerlaufspannungen angegeben. Die durchschnittliche Zellenspannung bei 20° bis 25° liegt voll aufgeladen um (2,3 ... 2,4) V. Der Ladeprozess beginnt, wenn die Ladespannung etwas höher als die Zellenspannung des geladenen Akkus ist. Ab diesem Moment werden die chemischen Reaktionen der Entladung umgekehrt. Gegen Ende des Ladevorgangs nimmt die elektrolytische Zersetzung des Wassers zu. An einer ungeregelten Ladestation beginnen die Zellen stark zu gasen. Das Wasserstoff-/Sauerstoffgasgemisch, trivial Knallgas genannt, ist leicht entzündbar. Bei Akkus im stationären Pufferbetrieb als Notstromquelle muss daher der Ladestrom auf einen niedrigen Ladeerhaltungsstrom abgesenkt werden.
Die Ladespannung für die Normalladung liegt bei (2,35 ... 2,4) V pro Zelle. Bei einer langsameren Schonladung sind es (2,28 ... 2,3) V pro Zelle. Stationäre Akkus werden zum Erhalt ihrer Ladung mit einer Zellenspannung zwischen (2,23 ... 2,25) V versorgt.
Verglichen mit der Primärzelle ist der Innenwiderstand der Akkuzelle um mindestens eine Zehnerpotenz niedriger. Blei-Gel-Akkus haben einen höheren Innenwiderstand als Blei-Säure-Akkus oder die Vliesvariante, da das Gel die freie Beweglichkeit der Ionen einschränkt. Die auslaufsicheren Bleiakkus sind bis auf ein Überdruckventil hermetisch verschlossen und hinsichtlich des Füllstands des Elektrolyten wartungsfrei.
△Nickel-Eisen-Akku
Ein anderes, lange bekanntes Sekundärelement ist der Nickel-Eisen-Akkumulator. Der Minuspol ist mit einer Eisenelektrode und der Pluspol mit einer Nickel(III)-Oxid-Hydroxid überzogenen Nickelelektroden verbunden. Die chemischen Redoxreaktionen finden im alkalischen Milieu einer wässrigen Lösung von Kaliumhydroxid statt. Die Elektrolytkonzentration bleibt stets gleich, da bei geschlossenem Stromkreis nur Hydroxidionen im Elektrolyten ausgetauscht werden. Die Urspannung einer Zelle liegt bei 1,2 Volt.
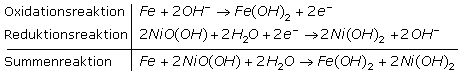
Der Ni-Fe-Akku ist nahezu unverwüstlich denn Tiefentladungen und lange Lagerzeiten ohne Wartung schaden nicht. Er wird derzeit in Anlagen zur unabhängigen Stromversorgung und als Speicher in Solar- und Windstromanlagen eingesetzt. Nachteilig kann die Abgabe von Wasserstoff beim Ladeprozess und die Reaktion der Kalilauge mit dem Kohlendioxid der Luft zu Kaliumkarbonat bei offenen Akkusystemen sein.
△Nickel-Cadmium-Akku
Diese wieder aufladbaren Zellen gibt es in offener und gasdichter Bauart. Letztere wurden viele Jahre als Ersatz für Batterien verwendet. Ab 2005 gilt ein EU-weites Vertriebsverbot aufgrund der hohen Giftigkeit des Cadmiums. Die Ni-Cd-Akkus werden durch Nickel-Metallhydrid und Lithiumionen-Akkumulatoren ersetzt. Ni-Cd-Akkus gelten als Sondermüll und die Rohstoffe können bei ordnungsgemäßer Entsorgung sehr gut wiederverwendet werden.
In einem Nickel-Cadmium-Akkumulator ist die Eisenelektrode durch eine Cadmium- oder Eisen-Cadmium-Mischelektrode ersetzt worden. Die Urspannung der Zelle beträgt 1,3 Volt. Kalilauge bildet den alkalischen Elektrolyten. Die Zelle zeichnet sich durch einen sehr niedrigen Innenwiderstand aus und eignet sich für große Stromlasten. Der Akkutyp reagiert empfindlich auf Tiefentladungen mit dauerhaftem Kapazitätsverlust. Beim Ladevorgang muss ein Überladen durch Verringerung des Ladestroms vorgesehen sein, da es sonst zur Gasentwicklung mit Zerstörung der Zelle kommt.
Im alkalischen Nickel-Cadmium-Akku wird Cadmium zum zweiwertigen Cadmiumion oxidiert und bildet die negative Elektrode bildet. Mit geschlossenem Stromkreis findet an der Elektrode die Reduktion des dreiwertigen Nickel-Oxid-Hydroxids zu zweiwertigem Nickelhydroxid statt. Im Elektrolyten sorgen Hydroxidionen für den Stromtransport. Die Konzentration der Kalilauge bleibt unverändert.
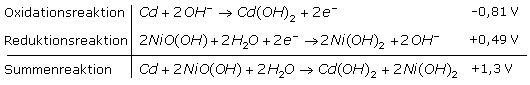
Die Ladespannung des aufgeladenen Akkus erreicht einen Wert, der das Wasser in der Zelle elektrolytisch spaltet. Im gasdichten Akku baut sich schädlicher Überdruck auf. Um das zu verhindern, ist im Anodenraum die Cadmiumelektrode etwas überdimensioniert und im Kathodenraum befindet sich Cadmiumhydroxid als Depolarisator. Der Stromfluss reduziert es zu Cadmium, das mit Sauerstoff zu Cadmiumoxid reagiert. In alkalisch wässriger Lösung reagiert es weiter zu Cadmiumhydroxid und bindet so den Sauerstoff.
Ein Überladen sollte dennoch vermieden werden, da die auftretende Reaktionswärme den Akku schädigt und sich dauerhaft elektrisch inaktive Gitterstrukturen der Reaktionspartner bilden können. Eine Ladezustandserhaltung mit einem Zehntel des Ladestroms wird ohne Schaden hingenommen und bei vollgeladenem Akku in Wärme umgesetzt. Nickel-Cadmium-Akkus sollten nicht parallel geschaltet werden. Auch unbelastet treten bei unterschiedlichen Innenwiderständen und Ladezuständen Ausgleichströme auf, die zu irreversiblen Schäden führen können.
△Nickel-Metallhydrid- oder NiMH-Akku
Einige Metalle, zu denen auch Nickel und spezielle Legierungen zählen, können Wasserstoff erst anlagern und anschließend im Kristallgitter atomar einlagern. Dabei bilden sich Metallhydride unterschiedlicher Zusammensetzung in denen der Wasserstoff atomar oder gebunden mit der Formalladung −1 auftreten kann.
Der Minuspol des aufgeladenen NiMH-Akkus besteht aus einer Nickelmetalllegierung mit eingelagertem Wasserstoff, dem Metallhydrid MH. Der Wasserstoff wird im alkalischen Elektrolyten zu Wasser oxidiert und wird zum Donator (Spender) für Elektronen. Der Pluspol besteht aus einer mit dreiwertigem Nickel-Oxid-Hydroxid überzogenen Nickelelektrode. Bei geschlossenem Stromkreis wird es zum zweiwertigen Nickelhydroxid reduziert. Ein Separator trennt die beiden Elektroden voneinander und ist mit dem Elektrolyt, einer 20%-igen Kaliumhydroxidlösung getränkt. Die MH-Elektrode ist überdimensioniert, damit kein Nickelmetall oxidiert werden kann. Die formalen Reaktionsgleichungen lassen sich vereinfacht wie folgt schreiben:
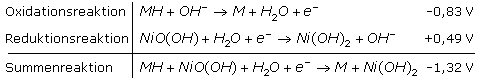
Im Vergleich mit dem Ni-Cd-Akku hat der NiMH-Akku eine höhere Energiedichte, die der Alkalimangan Primärzelle gleichkommt. Der NiMH-Akku hat keinen Memory-Effekt, dafür aber einen Trägheitseffekt, der nach mehrfacher Teilentladung auftritt. Er kann durch einige vollständige Lade- und Entladezyklen rückgängig gemacht werden. NiMH-Akkus werden durch Tiefentladungen ebenso dauerhaft geschädigt wie durch Falschpolung oder in überhitzter Umgebung. Sie sollten nicht parallel geschaltet werden. NiMH-Akkus verlieren bei Temperaturen unter 0°C ihre Kapazität. Die Selbstentladerate ist in den ersten Tagen nach der Ladung besonders hoch und nimmt dann bis auf 1% pro Tag ab.
△Lithium-Ionen-Akku
In den Handel sind Lithium-Ionen-Akkus nach 1990 mit stetig zunehmendem Entwicklungspotenzial gekommen. In der Redoxkette der Spannungserzeugung sind nur Lithiumionen und kein metallisches Lithium beteiligt. Der Einsatz von Li-Ionenakkus sollte im Vergleich zu Li-Batterien mehr Sicherheit bieten. Sie zeichnen sich durch eine sehr hohe Energiedichte aus. Ihre Zellenspannung ist fast dreimal so hoch wie die einer NiMH-Zelle.
Alle Li-Ionen-Systeme verwenden absolut wasserfreie, meist brennbare Lösungsmittel und besitzen spezielle Separatoren, die den Anoden- und Kathodenraum trennen. Zu große mechanische Belastung kann den Separator zerstören und zum inneren Kurzschluss mit Explosions- und Brandgefahr führen. Die Li-Ionenakkus haben keinen Memoryeffekt, sind aber empfindlich gegen Tiefentladung und Überladung. Beide Zustände werden meist mit einer im Akkupack integrierten Elektronik überwacht. Zur Ladung sind spezielle Ladegeräte mit abgestimmter Regelelektronik notwendig. Die durchschnittliche Lebensdauer bei optimaler Pflege wird mit 500 Lade-/Entladezyklen angegeben. Sie ist damit nur halb so hoch wie die der NiMH-Akkus, die aber erfahrungsgemäß auch eher versagen.
Äußerer Minuspol
Intern ist es der Anodenraum, wo formal Lithium zum Ion oxidiert wird und dabei das Elektron an die Elektrode abgibt. Eine Kupferelektrode dient als Stromleiter und ist mit der negativen Systemelektrode (Anode) verbunden. In den meisten Systemen besteht das Anodenmaterial aus Graphit mit eingelagerten Lithiumionen. Graphit bildet ein hexagonales Schichtengitter hoher Bindungsstärke und geringerer Bindekraft zu den Nachbarschichten. Durch Van-der-Waals-Kräfte gehalten lassen sich reversibel kleinere Ionen, Metallatome und Moleküle zwischen den Schichtebenen einlagern. Der Prozess wird Interkalation genannt. Die Kohlenstoffebenen liegen im Interkalationskomplex deckungsgleich übereinander. Das Elektrodenpotenzial beträgt −2,55 V gegen die Standardwasserstoffelektrode.
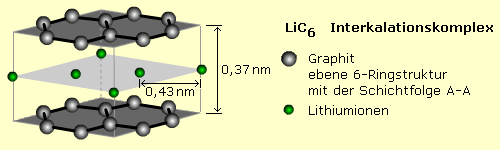
Eine bedeutende Weiterentwicklung ist der Einsatz von nanokristallinem Lithiumtitanat LTO Li4Ti5012 in Spinellstruktur. Das Elektrodenpotenzial gegen Lithium gemessen liegt bei 1,55 V. Durch die Nanostruktur vergrößert sich die wirksame Elektrodenoberfläche bis auf das 30-fache im Vergleich zur Graphitelektrode. Besondere Vorteile sind der schnelle Ladungsaustausch, der hohe Stromlasten und sehr kurze Ladezeiten erlaubt. Lithium-Titanat-Akkus sollen zehntausend und mehr Lade-/Entladezyklen standhalten. Nachteilig sind geringere Kapazitäten und Zellenspannungen von 2 ... 2,5 V.
Äußerer Pluspol
Intern ist es der Kathodenraum, wo formal das Lithiumion reduziert wird und dabei ein Elektron aufnimmt. Aluminium dient nach außen als Stromleiter und ist mit der Systemelektrode (Kathode) beschichtet. Das Kathodenmaterial ist eine Verbindung zwischen Lithium mit Kobalt- oder Nickel-Übergangsmetalloxiden. Oftmals ist es Lithium-Kobaltdioxid LiCoO2 gefolgt von Lithium-Nickeldioxid LiNiO2. Die tatsächlich ablaufende Redoxreaktion beruht auf einem Wertigkeitswechsel der Übergangsmetallionen des Kathodenmaterials. Die Verbindungen geben dem Lithiumionenakku eine hohe Energiedichte, sind aber nicht langzeitstabil. Bei der Einlagerung von Lithium ändert sich die Kristallstruktur. Mit dem Leitsalz im Elektrolyten entstehen Reaktionsprodukte, die den Innenwiderstand der Zelle dauerhaft erhöhen. Diese Systeme vertragen weder beim Laden noch Entladen zu hohe Stromlasten.
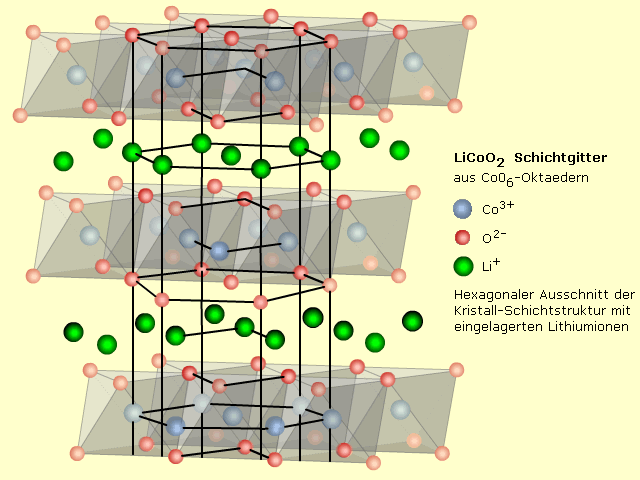
Ein neuerer, interessanter Elektrodenwerkstoff ist Lithiummanganoxid LiMn204 mit dreidimensionaler Spinellstruktur. Diese Kristallstruktur erlaubt einen zweidimensionalen Ionenaustausch, wodurch die Wanderung der Lithiumionen viel leichter und schneller erfolgen kann. Diese Eigenschaft bedingt einen geringeren Innenwiderstand der Zelle. Im Vergleich zum Lithiumkobaltdioxid ist das LiMn204 stabil und bildet keine störenden Reaktionsprodukte mit dem Elektrolyten. Der Innenwiderstand bleibt langzeitstabil. Die Dauer- und Impulsstrombelastbarkeit ist um 10 ... 40-mal höher. Von Nachteil sind Kristallstrukturänderungen bei der Lithiumeinlagerung und die rund halb so große Energiedichte.
Ein ebenfalls neuerer Kathodenwerkstoff ist Lithium-Eisenphosphat LiFePO4 mit Olivinkristallgitter. Die Kristallstruktur bleibt bei der Einlagerung erhalten. Die Zellspannung erreicht 3 ... 3,3 Volt. Es sind sehr hohe Stromlasten möglich.
Leitsalz und Elektrolyt
Hauptsächlich werden Lithiumhexafluorophosphat LiPF6 und Lithiumperchlorat LiClO4 als Leitsalz in absolut wasserfreien organischen aprotischen Lösungsmitteln verwendet. Das sind Mischungen aus Propylenkarbonat, das bei Raumtemperatur flüssig ist oder Ethylenkarbonat, das bei Raumtemperatur fest ist und sich in 1,2-Dimethoxyethan oder Diethylkarbonat (Kohlensäurediethylesther) als Lösungsmittel befindet.
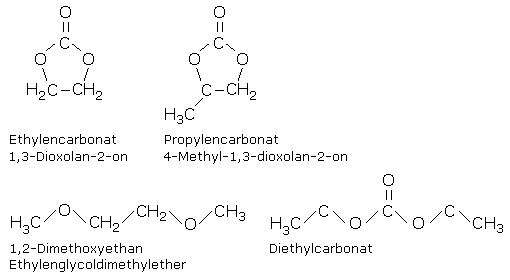
An der Graphitoberfläche kann katalytisch beeinflusst der Elektrolyt mit den im chemischen Gleichgewicht stehenden verschiedenen Ionen aus dem Leitsalz neue chemische Verbindungen bilden. Dabei entsteht eine bis zu 50 nm wenige Moleküllagen hohe Schicht aus Lithiumoxid, Lithiumfluorid und Lithiumkarbonat. Sie wird als Solid Electrolyte Interface (SEI) bezeichnet und passiviert die Elektrodenoberfläche. Diese Lithiumverbindungen sind für Lithiumionen durchlässig. Sie behindert allerdings den Ionenaustausch und erhöht dauerhaft den Innenwiderstand. Nebenher können bei einer Spaltung der Lösungsmittelmoleküle auch aggressive Li-Polymerverbindungen entstehen, die der Zelle schaden. Der Materialverbrauch verringert in jedem Fall die anfängliche Kapazität der Zelle. Am Lithiumtitanat, der LTO-Elektrode wurde keine SEI-Bildung nachgewiesen.
Elektrodenreaktionen
Vereinfacht beschrieben gibt das Anodenmaterial bei der Entladung Lithiumionen in den Elektrolyten ab. Die Elektronen wandern über den äußeren Stromkreis zum Kathodenmaterial, das ebenso viele Lithiumionen einlagert. Im Reaktionsablauf tritt kein metallisches Lithium auf. Das Potenzial des Übergangsmetalloxids beträgt ≈1 V gemessen gegen die Normalwasserstoffelektrode. Der von den Lithiumionen unterstützte Redoxvorgang in der Kathode beruht auf einem Wertigkeitswechsel des Übergangsmetalls.
Es folgen die prinzipiellen Redoxgleichungen für einen Lithium-Kobaltdioxid-Akku mit Li-Graphit-Interkalationskomplex als Anode. In der Reaktionsgleichung steht Me für Kobalt Co oder Nickel Ni, als Übergangsmetall.
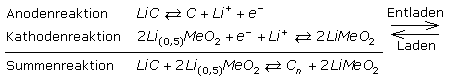
Im Lithium-Manganspinell-Akku ist das Kathodenmaterial durch ein in der Anwendung sicheres LiMn2O4 ersetzt. Als Anode dient weiterhin Li-Graphit.
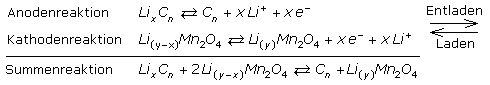
Im Lithium-Titanat-Akku ist die Li-Graphit-Anode durch Lithiumtitanat (LTO) mit Spinellkristallstruktur ersetzt. Das Material reagiert nicht mit dem Elektrolyten und bildet kein störendes SEI. Der Ionenaustausch bei Spinellen kann in horizontaler und vertikaler Richtung und folglich schneller ablaufen.
Im Lithium-Eisenphosphat-Akku ist das Kathodenmaterial durch (LFP) LiFePO4 ersetzt. Das Material ist preisgünstig und umweltverträglich. Sicherheitsrisiken sind so gut wie ausgeschlossen. Die Ionenreaktionen im normalen LFP vollziehen sich nur langsam. Die Leitfähigkeit wird daher durch Zusätze von Graphit und Fremdmetallatomen verbessert. Für die Korngrößen werden Nanostrukturen angestrebt.
Die nahe Zukunft wird zeigen, ob sind in Verbindung mit einer Lithium-Titanat-Anode Lithium-Ionenakkus mit hohem Sicherheitsfaktor und großer Langzeitstabilität herstellen lassen. Ein in dieser Hinsicht sehr interessantes Anodenmaterial ist Silizium. Die Kristallstruktur kann pro Siliziumatom im Interkalationskomplex bis zu vier Lithiumionen einlagern und ist damit dem Graphit weit überlegen. Normales Silizium reagiert mit Volumenänderung beim Einlagern und ist als Elektrodenmaterial nicht geeignet. Gute Aussichten bestehen bei nanostrukturiertem Silizium.
△Lithium-Polymer-Akku
Der Lithium-Polymer-Akku ist dem Lithium-Ionen-Akku sehr ähnlich. Das Anodenmaterial, der äußere Minuspol, ist ein Lithium-Graphit Interkalationskomplex. Das Kathodenmaterial, der äußere Pluspol, besteht aus Lithium-Übergangsmetalloxiden. Das Leitsalz ist in einer nichtflüssigen Polymerfolie eingelagert. Die Folienbauweise erlaubt es, Akkus in jeder beliebigen Form herzustellen. Sie lassen sich auch zur Rundzelle zusammenrollen.
Bei Raumtemperatur ist die Ionenbeweglichkeit im festen Elektrolyten sehr gering. Für den allgemeinen Einsatz in Handys, im Modellbau und in vielen mobilen Kleingeräten werden gelartige Polymerelektrolyte verwendet. Bei einer Foliendicke von einigen 100 μm ist der Ionenaustausch schnell genug. Die Spannung einer Einzelzelle liegt bei 3,7 Volt.
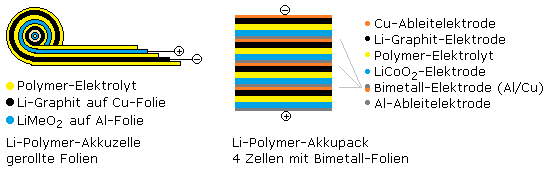
Durch Zusammenschalten einzelner Akkuzellen lassen sich höhere Nutzspannungen erzielen. Das Fraunhofer-Institut für Chemische Technologie ICT hat den Innenaufbau der Lithiumpolymer-Akkus optimiert. Der Einsatz von beidseitig beschichteten Bimetallfolien ergibt Akkupacks höherer Spannung bei geringerer Baugröße aber gleicher Energiedichte.
Die Lithium-Polymer-Akkus werden mit einer integrierten Elektronik hergestellt. Sie überwacht das Unter- und Überschreiten der sicheren Betriebsspannungen. Da die Ladegeräte auf diese Elektronik abgestimmt sind, ist man beim Akkuersatz oftmals an den Hersteller gebunden. Die Akkuzellen dürfen parallel geschaltet werden. Der Ausfall einzelner Zellen kann nicht repariert werden, da aus Sicherheitsgründen beim Öffnen des Akkupacks alle Zellen durch die Elektronik unbrauchbar gemacht werden.