Klassische Atommodelle und Bindungsarten
Das einfachste Element ist der Wasserstoff, der aus einem Proton im Kern und einem Elektron in der Hülle besteht. Die Atomkerne der schwereren Elemente haben zusätzlich zu Protonen noch Neutronen. Zu jedem Proton im Kern gehört genau ein Elektron in der Hülle. Im Jahr 1913 schlug der dänische Physiker Niels Bohr in seinem Atommodell vor, dass die den Atomkern umkreisenden Elektronen nur ganz bestimmte Energiezustände einnehmen können. Die Elektronen sollen dann auf diesen Bahnen ohne Energieabstrahlung den Kern umkreisen.
Mit ausreichender Energiezufuhr, hier ein Lichtblitz, können Elektronen auf entfernte, energetisch höher liegende Bahnen springen. Nach kurzer Verweildauer fallen sie in den niedrigeren Energiezustand zurück und geben eine definierte Energiemenge ab, die hier als diskrete Lichtfrequenz dargestellt ist. Angeregte Atome oder Moleküle lassen sich anhand ihrer charakteristischen Linienspektren bestimmen. Der Energieaustausch erfolgt stets in ganzzahligen Vielfachen (n), der von Max Planck entdeckten und nach ihm benannten universellen Naturkonstanten, dem Planckschen Wirkungsquantum h = 6,625 · 10−34 J·s. Die Frequenz f der Lichtquanten entspricht der Energiedifferenz der übersprungenen Elektronenbahnen. (E2 − E1) = n·h·f.
Das nach Bohr benannte Atommodell gestattete eine erste Deutung der bekannten Linienspektren energetisch angeregter Elemente. Die errechneten Ergebnisse stimmten beim Wasserstoff sehr gut mit den praktischen Messwerten überein. Sie weichen jedoch bei Atomen höherer Ordnungszahlen voneinander ab. Unbestritten bleibt die Annahme, dass sich die emittierenden, Lichtquanten aussendenden Elektronen auf bestimmten Energieniveaus befinden müssen.
Orbitalmodell
Eine Weiterentwicklung und Verbesserung des Bohrschen Atommodells führte zur Orbitaltheorie. Werner Heisenberg entwickelte mathematische Lösungen, die als Unschärferelation bekannt sind. Danach ist es nicht möglich, den Ort eines Teilchens und seinen Impuls gleichzeitig korrekt zu bestimmen. Die festen Kreisbahnen im Bohrschen Atommodell verwischten somit vereinfacht beschrieben zu Bändern.
Louis de Broglie übernahm von Albert Einstein die Auffassung, dass Lichtwellen auch Teilcheneigenschaften, als Lichtquanten bezeichnet, besitzen. Die Umkehrung dieser Annahme besagt, dass Materie auch über Welleneigenschaften verfügt. Er schlug 1924 als Bezeichnung Materiewellen vor. Damit sollten Elektronenbewegungen um den Kern bestimmbar werden. Erwin Schrödinger nahm diese Idee auf und entwickelte 1927 die mathematische Erklärung. Es ist die nach ihm benannte Schrödinger-Gleichung. Im gleichen Jahr wurde die Annahme von Louis de Broglie auch im Experiment bestätigt.
Die Schrödinger-Gleichung liefert eine Verbindung zwischen Welleneigenschaften der Energie und den Ort des Elektrons. Als Ergebnis erhält man die Aufenthaltswahrscheinlichkeiten des Elektrons. Sie stehen für die Raumelemente, in denen ein Elektron am häufigsten sein wird. Aus der unendlichen Anzahl von Wellenfunktionen sind aber nur einige davon sinnvoll. Neben weiteren Randbedingungen muss als wichtige Bedingung erfüllt sein, dass die Gesamtenergie des Elektrons nur bestimmte gequantelte Werte annehmen kann. Die Wellenfunktion als Eigenfunktion der Elektronen führt genau dann zu den Atomorbitalen. Mit ihnen kann der wahrscheinliche Aufenthalt bildlich dargestellt werden.
Die Besetzung der einzelnen Atomorbitale durch Elektronen ist unterschiedlich. Orbitale in der Nähe des Atomkerns können nur weniger Elektronen aufnehmen als weiter entfernte Bänder. Die Elektronen selbst verfügen noch über einen Eigendrehimpuls, dem Elektronenspin. Er kann nicht durch eine einfache mechanisch physikalische Vorstellung wie der Rotation um die körpereigene Achse erklärt werden. Der Spin wird mathematisch quantenmechanisch hergeleitet. Mit den mathematischen Modellen schreibt man den Elektronen insgesamt vier Quantenzahlen zu. Nach dem Prinzip von Wolfgang Pauli sind in einem Mehrelektronensystem die Quantenzahlen zweier Elektronen niemals völlig gleich. Mit all dem ist man in der Lage die Elektronenkonfigurationen der nicht angeregten Grundzustände aller Elemente zu beschreiben.
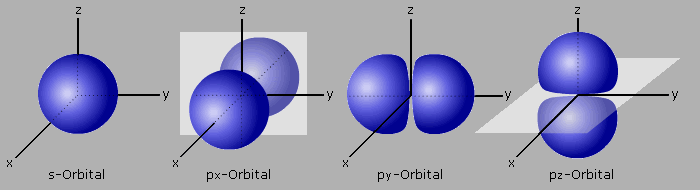
Jede der sieben Hauptquantenzahlen verfügt über ein s-Orbital, dem eine kugelförmige Gestalt zugeschrieben wird. Jedes s-Orbital kann maximal 2 Elektronen aufnehmen.
Ab der Hauptquantenzahl 2 gibt es drei p-Orbitale (px- py- pz). Sie werden als hantelförmig beschrieben und liegen in Richtung der x-, y-, z-Raumachse. Jedes dieser Orbitale kann maximal 2 Elektronen aufnehmen.
Ab der Hauptquantenzahl 3 kommen fünf d-Orbitale dazu. Drei der d-Orbitale haben das Aussehen einer Doppelhantel. Sie liegen in der Ebene zwischen den Raumachsen (dxy- dxz- dyz). Die vierte Doppelhantel (dx2-y2) umschließt die x,y-Achsen. Das fünfte d-Orbital (dz2) bildet eine Hantel mit Mittelring mit der z-Achse als Rotationsachse. Jedes einzelne d-Orbital nimmt maximal nur 2 Elektronen auf.
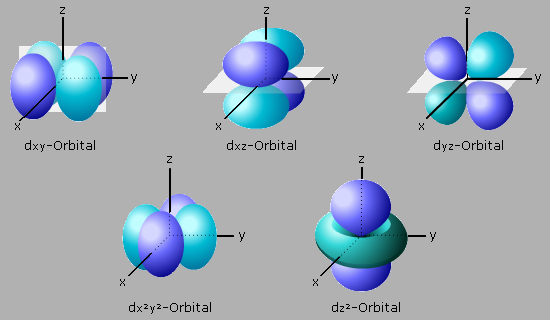
Ab der Hauptquantenzahl 4 kommen sieben f-Orbitale hinzu, die sich anschaulich so nicht mehr beschreiben lassen. Sie bieten Raum für insgesamt 18 Elektronen. Bei der Besetzung der Orbitale durch Elektronen werden noch zusätzlich besondere energetische Feinstrukturen ausgebildet.
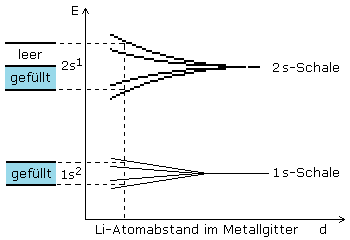
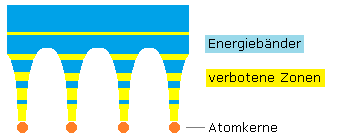
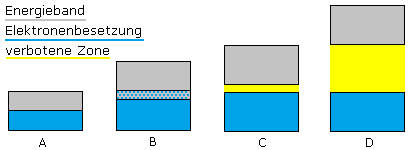
Im Grundzustand der Elemente sind halb besetzte Orbitale energetisch begünstigt, wenn man sie mit schwach besetzten oder fast voll belegten Orbitalen vergleicht. Diese Elemente sind daher auch reaktionsträger als ihre im Periodensystem der Elemente angeordneten Nachbarelemente. Das letzte nicht vollständig aufgefüllte Orbital enthält die Valenz- oder Bindungselektronen und wird als Valenzband bezeichnet.
Die Edelgase gehören zu den Elementen mit komplett voll besetzten Orbitalen. Die Elemente der Edelgasgruppe sind energetisch besonders stabil. Sie sind besonders reaktionsträge und verbleiben für sich im atomaren Zustand. Wasserstoff, Sauerstoff und Stickstoff schließen sich zu Molekülen zusammen.
Chemische Bindungsarten
Bei allen Elementen und Elementkombinationen, den Molekülen und chemischen Verbindungen, kommt es zwischen den Valenzelektronen zu Wechselwirkungen. Durch die Ausbildung von Bindungen entstehen energetisch niedrigere und somit stabilere Zustände. Man unterscheidet zwischen vier Hauptvalenzbindungen:
Kovalente Bindung
Die kovalente Bindung ist eine reine Elektronenpaarbindung, die auch homöopolare Bindung heißt. Die an den Bindungen beteiligten Atome teilen sich ihre Valenzelektronen auf. Formal besitzt dadurch jedes der Atome im zeitlichen Mittel durch die Elektronenpaarbildung komplett gefüllte Orbitale.
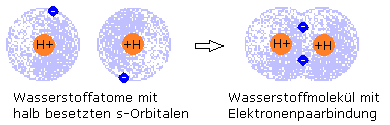
Wasserstoff kommt normalerweise nur molekular vor. Zwei H-Atom mit ihren halb besetzten s-Orbitalen treten in Wechselwirkung miteinander, wobei sich die beide Orbitale überlappen. Für sich gesehen hat jedes s-Orbital jetzt Anteil an 2 Elektronen, einem Elektronenpaar. Es erlangt damit kurzzeitig einen energetisch niedrigeren Zustand, wodurch das Wasserstoffmolekül gegenüber dem atomaren Wasserstoff den stabileren Zustand hat.
Zwei Chloratome mit jeweils 7 Valenzelektronen (2s- und 5p-Elektronen) schließen sich zum Chlormolekül zusammen. Es entsteht eine Elektronenpaarbindung bei der sich zwei halb besetzte p-Orbitale überlappen. Das Valenzband erreicht die scheinbar vollständige Besetzung mit 8 Elektronen. Sie wird Edelgaskonfiguration genannt und ist energetisch besonders günstig.
Das Sauerstoffatom hat auf seiner Außenschale 6 Valenzelektronen. Das s-Orbital ist mit 2 Elektronen komplett besetzt und im Bild nicht dargestellt. In der Abbildung wird das pz-Orbital mit 2 Elektronen als voll besetzt angenommen. Einfach besetzt dagegen ist das px- und py-Orbital. Im Sauerstoffmolekül überlappen die jeweiligen px- und py-Orbitale zu Bindungsorbitalen. Es entstehen zwei Elektronenpaarbindungen. Jedes Sauerstoffatom scheint somit im Mittel ein komplett besetztes p-Orbital zu haben.
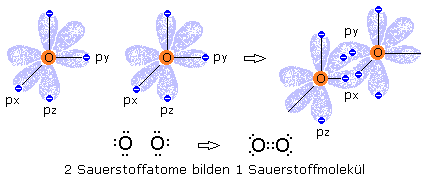
Zwei Stickstoffatome mit ihren 5 Valenzelektronen bilden im Stickstoffmolekül drei Elektronenpaarbindungen und erreicht so einen energetisch günstigen stabilen Zustand. Bei Kohlenstoffatomen in der Grafitmodifikation kommt es zu Elektronenpaarbindungen zwischen benachbarten Kohlenstoffatomen innerhalb einer Ebene. Das Kohlenstoffatom besitzt 4 Valenzelektronen und erreicht die sogenannte Edelgaskonfiguration durch 4 Elektronenpaarbindungen.
Im Wassermolekül fehlen dem Sauerstoffatom 2 Elektronen zur vollständigen Besetzung aller p-Orbitale. Die Wasserstoffatome können diese Elektronen zu Verfügung stellen. Bei der Wechselwirkung des Wasserstoff s-Orbitals mit einem Sauerstoff p-Orbital erreichen beide Elemente einen energetisch niedrigeren und folglich stabileren Zustand. Die räumliche Anordnung der p-Orbitale und die Tatsache, dass die Bindungspartner eine unterschiedlich starke Anziehung auf Elektronen haben, gibt dem Wassermolekül seine charakteristische Dipoleigenschaft. Wasser besitzt eine polarisierte Atombindung.
Koordinative Bindung
Die koordinative oder semipolare Bindung stellt einen Sonderfall der kovalenten Bindung dar. Bei ihr reagieren verschiedene Moleküle miteinander, die für sich genommen kovalente Bindungen aufweisen. Rein schematisch betrachtet gibt dabei einer der Reaktionspartner Valenzelektronen an den anderen Bindungspartner ab. In jedem Partner sind dann nur noch die energetisch günstigen Orbitale mit Elektronen besetzt. Diesen Bindungstyp trifft man in vielen Komplexverbindungen und bei den metallorganischen Verbindungen an.
Heteropolare Bindung
Heteropolare Bindungen werden auch als Ionenbindung oder Elektrovalenz bezeichnet. Sie beruht auf der elektrostatischen Anziehung entgegengesetzt geladener Ionen. Ionen bilden sich aus den beteiligten Atomen durch die Aufnahme oder Abgabe von Valenzelektronen. Das zum Ion gewordene Atom hat nur noch komplett gefüllte Orbitale. Ionen sind positiv oder negativ geladene Teilchen, die für sich alleine nicht stabil sind.
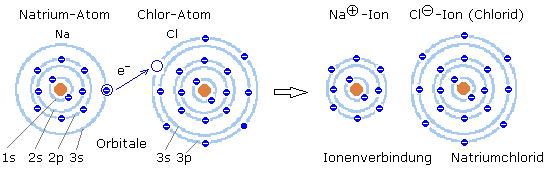
Im Natriumchlorid, dem Kochsalz, besitzt das Natriumatom 1 Elektron im Valenzband, der 3s-Schale. Dem Chloratom fehlt zur vollständigen Orbitalbesetzung seines Valenzbands, der 3p-Schale, genau 1 Elektron. Gibt das Natriumatom sein Außenelektron an das Chlor ab, so ist die Energiebilanz der Orbitale beider Atome günstiger. Aus den zuvor elektrisch neutralen Atomen sind Ionen geworden. Das Natriumion ist einfach positiv, das Chlorion einfach negativ geladen. Die Verbindung Natriumchlorid ist im Kristallgitter und in wässriger Lösung elektrisch neutral. Die Atomradien und Ionenradien weisen deutliche Unterschiede auf.
- Teilchenradien in Ångström ( 1 Å = 10−10 m )
- Atomradius vom Natrium Na : 1,9 Å Ionenradius Na+ : 0,95 Å
- Atomradius vom Chlor Cl : 0,8 Å Ionenradius Cl¯ : 1,81 Å
Heteropolare Bindungen bilden sich bevorzugt zwischen Metallen und ausgesprochenen Nichtmetallen aus. Die gegenseitige elektrostatische Anziehung, die Bindungskraft kann mithilfe des Coulombschen Gesetzes berechnet werden. Die Ionenbindung ist ungerichtet, da die Ladungskräfte eine kugelförmige Verteilung aufweisen. Im Ionenkristallgitter ist jede Ionenart von der größtmöglichen Anzahl entgegengesetzt geladener Ionen umgeben. Die Koordinationszahl hängt vom jeweiligen Ionenradius der beteiligten Kationen und Anionen ab. Ionenkristalle sind im Normalfall keine elektrischen Leiter. In ihren Kristallgittern stehen keine freien Elektronen zum Ladungstransport zur Verfügung.
Metallische Bindung
Die Valenzelektronen der Metalle lassen sich keinem speziellen Atompaar zuordnen. Sie gehören dem gesamten Atomgitter an. Bei metallischen Bindungen sind die an der Bindung beteiligten Elektronen innerhalb des Metallgitters ziemlich frei beweglich. Diese Bindungsart unterscheidet sich damit wesentlich von den lokalisierten, örtlich begrenzten Bindungen. Man findet sie nicht nur bei den reinen Metallen, sondern auch bei deren Legierungen.